✽療程仿單名稱、療程適應症、療程風險、禁忌症與副作用...等其他注意事項
■療程仿單名稱
淨優明凍晶注射劑
Xeomin Powder for Solution for Injection
衛部菌疫輸字 第 000994 號
■療程適應症
- 皺眉紋
- 魚尾紋
- 水平抬頭紋
- 眼瞼痙攣
[說明: 本適應症臨床試驗收納的病人為先前已接受過Botox並有穩定療效反應的病人;參見臨床試驗資料(12)]
- 頸部肌張力不全(痙攣性斜頸)
- 上肢痙攣
警語:毒素作用遠端擴散
上市後的報告顯示,XEOMIN及所有肉毒桿菌毒素產品的效果都可能會從注射區域擴散,從而引發和肉毒桿菌毒素之作用相符的症狀。這些症狀可能包括虛弱、全身肌肉無力、複視、視覺模糊、眼瞼下垂、吞嚥困難、發聲障礙、發音困難、尿失禁、以及呼吸困難。曾有在注射數小時至數週後發生這些症狀的報告。治療神經性適應症時發生吞嚥困難與呼吸困難可能會危及生命,並且曾有死亡的報告。治療醫學美容適應症時,這些不良反應的可能性無法完全排除。這些症狀可能會發生於患有會促發這些症狀之疾病的病人。在未獲核准的使用案例 (包括兒童的痙攣狀態),以及核准的適應症中,使用與治療頸部肌張力不全相當或較低的劑量,都發生過作用擴散的案例。
■療程風險、禁忌症、副作用
【禁忌症】
- 過敏
已知對活性成分肉毒桿菌神經毒素A型或任何賦形劑(人類白蛋白、蔗糖)過敏的病人,使用本品可能會引發具生命威脅性的過敏反應。XEOMIN禁用於已知對任何肉毒桿菌毒素製品過敏或對配方中之任何成分過敏的病人[參見警語及注意事項(5.5)與性狀(1)]。如果發生嚴重的(例如全身性過敏反應)和/或立即性過敏反應,應該制定適當的藥物治療。
- 原先即患有神經肌肉疾病的病人
在一般的 XEOMIN 建議劑量下,患有神經肌肉疾病的病人發生臨床不良反應 (包括吞嚥困難及呼吸困難) 的風險較高。XEOMIN 禁用於有全身性肌肉活動力疾病 (如,重症肌無力、Lambert-Eaton 症候群) 的病人。
- 注射部位感染或發炎
對注射部位發生感染或發炎的病人,使用本品可能會引發嚴重的局部性或散播性感染。準備注射的部位有感染或發炎現象時,不可使用XEOMIN。
【警語/注意事項】
在施打XEOMIN之前,醫師應先瞭解病人的解剖構造,以及先前手術所造成的任何解剖學變化。
應小心注意不可將XEOMIN注入血管。治療頸部肌張力不全和痙攣時,如果XEOMIN的注射部位靠近易受傷害的組織,例如頸動脈、肺尖和食道,請務必謹慎。
應考量到水平抬頭紋可能不僅受動態因素影響,也可能是皮膚失去彈性所造成 (例如老化或光害),在此情況下,病人可能對肉毒桿菌毒素產品無反應。
下列狀況使用 XEOMIN 務必謹慎:
• 患有任何類型的出血疾病
• 病人正接受抗凝血藥物治療,或使用其他抗凝血藥物所含物質
• 患有肌萎縮性脊髓側索硬化症 (ALS) 的病人
• 患有其他疾病可能導致周邊神經肌肉功能障礙的病人
• 目標肌肉明顯無力或萎縮
不應注射超過XEOMIN的建議單次劑量。
對於原有動作不能或久坐不動的病人,為了神經性適應症而接受XEOMIN治療後,應建議病人在注射後逐漸恢復活動。
重複注射可能增加或減少 A 型肉毒桿菌神經毒素的臨床療效。造成臨床療效變化的可能原因包括配製技術不同、選擇的注射間隔時間、注射的肌肉,以及採用的生物檢測程序導致毒素活性略有差異,或是繼發性無反應。
【其他注意事項】
毒素作用擴散
XEOMIN及其它已獲核准之肉毒桿菌毒素產品的上市後安全性資料顯示,在某些病人中,肉毒桿菌毒素的作用範圍可能會超過局部注射的部位。其症狀和肉毒桿菌毒素的作用機制相符,可能包括虛弱、全身肌肉無力、複視、視覺模糊、眼瞼下垂、吞嚥困難、發聲障礙、發音困難、尿失禁、以及呼吸困難。曾有報告指出在注射數小時至數週後發生這些症狀,並且不良反應可能與毒素擴散到遠離注射部位處有關。接受治療劑量的病人,可能發生肌肉極度無力。吞嚥困難與呼吸困難可能會危及生命,並且曾有在因治療醫學美容適應症以外的神經性適應症時,因毒素作用擴散而死亡的報告。治療醫學美容適應症時,發生這些不良反應的可能性無法完全排除。這些症狀可能會發生於患有會促發這些症狀之疾病的病人。不建議注射XEOMIN於有吞嚥困難及呼吸困難的病人。用於尚未核准的用途(包括兒童的痙攣症狀)與已核准的適應症時,在適當劑量下,都曾有發生和毒素作用擴散相符之症狀的報告。應告知病人或照顧者,如果發生吞嚥、說話或呼吸障礙的現象,應立即就醫診治。A型肉毒桿菌神經毒素注射部位錯誤,可能導致鄰近肌群暫時性痲痹,大劑量可能造成遠離注射部位的肌肉麻痺。注射於頸部肌肉以外的部位,也曾有病人發生吞嚥困難。
肉毒桿菌毒素產品之間不具可交換性
XEOMIN (incobotulinumtoxinA)注射劑的效價單位對所採用的製備方法及分析方法具有特異性。XEOMIN並不能和其它的肉毒桿菌毒素產品交替使用,因此,其生物活性的單位數也無法和任何其它肉毒桿菌毒素產品以任何其它特定分析方法評估而得的單位數進行比較或換算[參見性狀(1)]。
過敏反應
曾有在使用肉毒桿菌毒素產品時發生過敏反應的報告(過敏性反應(anaphylaxis)、血清病(serum sickness)、蕁麻疹、軟組織水腫以及呼吸困難)。如果發生嚴重及(或)立即性的過敏反應,應停止後續的XEOMIN注射,並立即採取適當的醫療措施。
原先即患有神經肌肉疾病的病人及其他特殊族群
患有神經肌肉疾病的病人,有較高的風險發生肌肉過度無力。這些病人須在專科醫師監督下施用 XEOMIN,且只有在評估治療效益大於風險的情況下才能使用。曾發生吞嚥困難和吸入異物的病人,在接受神經性適應症治療時必須非常小心,且不建議使用 XEOMIN 進行醫學美容適應症治療。
抗體形成
和所有的治療用蛋白質製劑一樣,本品也可能會產生免疫刺激性。太過頻繁的注射,可能增加形成抗體的風險,可導致治療失敗(即使用於治療其他適應症)[參見副作用/不良反應(8.1)] 。
皺眉紋
使用XEOMIN治療皺眉紋的病人有發生眼瞼下垂的風險。[參見用法及用量(3.1.2.1)]投予XEOMIN時,切勿超過建議的劑量與投藥頻率。
眼瞼痙攣
應避免注射於提上眼瞼肌附近,以降低發生眼瞼下垂的風險。A 型肉毒桿菌神經毒素擴散到下斜肌(inferior oblique),可能發生複視。應避免從內側注射到下眼瞼,以降低此不良反應的風險。
A型肉毒桿菌神經毒素具有抗膽鹼作用,因此將XEOMIN用於可能發生狹角性青光眼的病人務必謹慎。為避免眼瞼外翻,應避免注射到下眼瞼區域。若有上皮缺損必須進行積極治療,包括保護性滴劑、軟膏、治療性隱形眼鏡,或以貼片或類似方式使眼睛閉合。因注射XEOMIN到輪匝肌造成眨眼次數減少,可能導致角膜暴露、持續性上皮缺損和角膜潰瘍,尤其是患有顱神經疾病 (顏面神經) 的病人。對於先前接受眼睛手術的病人,應針對角膜感覺仔細檢查。眼瞼的軟組織很容易出現瘀斑,立即輕壓注射點可以降低發生瘀斑的風險。
頸部肌張力不全(痙攣性斜頸)
應告知病人注射XEOMIN治療痙攣性斜頸,可能導致輕度至重度的吞嚥困難,並有吸入異物或呼吸困難的風險。可能需要醫療介入 (例如使用胃餵食管) (另請參見副作用/不良反應(8.2))。將注射到胸鎖乳突肌的劑量限制在 100 單位以下,可能可降低吞嚥困難的發生風險。頸部肌肉量較少或需要進行雙側胸鎖乳突肌注射的病人,發生吞嚥困難的風險較高。吞嚥困難的原因是由於XEOMIN的藥效擴散,神經毒素擴散至食道肌肉組織。
上肢痙攣
XEOMIN用於局部痙攣治療的研究,是搭配一般標準照護療程,不應取代標準療法。
XEOMIN 對於受固定攣縮影響的關節,在改善活動範圍方面不太可能有效果。
曾有病人產生新發生的癲癇發作或癲癇復發,通常是容易癲癇發作的病人,這些事件與注射
肉毒桿菌毒素的確切關係尚未證實。
【特殊族群注意事項】
- 懷孕
妊娠用藥分級C:
目前尚無任何適當且控制良好的孕婦研究。除非有很清楚的必要性,XEOMIN不應使用於懷孕婦女。對大鼠和兔子投予XEOMIN會對大鼠產生胚胎毒性,並會使兔子的流產率升高。
對懷孕的大鼠於器官發生期間以肌肉注射的方式投予XEOMIN時(於懷孕天數[GDs]達6、12及19天時投予3、10或30單位/公斤;或於GDs達6至19天時投予單位/公斤;或於GDs達6、9、12、16及19天時投予2、6或18單位/公斤),在也具有母體毒性的劑量下曾觀察到胎兒體重減輕及骨骼骨化作用減弱的現象。就胚胎毒性而言,對大鼠的無影響劑量為6單位/公斤。對懷孕的兔子於器官發生期間肌肉注射給藥(於GDs達6、18及28天時投予1.25、2.5或5.0單位/公斤)之後發現,在也具有母體毒性的最高劑量下會導致流產率升高。就流產率升高的現象而言,對兔子的無影響劑量為2.5單位/公斤。
- 哺乳
目前並不確知肉毒桿菌毒素A型是否會分泌進入人類的乳汁。於授乳期間不建議使用本品。
- 小兒
XEOMIN用於18歲以下之病人的安全性及有效性尚未確立[參見警語及注意事項(5.5)]。
- 老年人
老年人之使用
皺眉紋:在針對皺眉紋所進行的臨床研究中,對65歲 (含)以上之受試者使用XEOMIN的臨床資料相當有限。在參與安慰劑對照性臨床研究0724與0741的全部受試者中,有21位(4%)受試者的年齡為65歲(含)以上。在接受XEOMIN治療的65歲(含)以上的受試者中,有20% (3/15)出現療效。從老年受試者的整個安全性資料庫來看,和使用XEOMIN治療相關之不良事件的發生率並無升高的現象。
魚尾紋:目前尚無65歲 (含)以上病人使用XEOMIN治療魚尾紋之臨床經驗。
水平抬頭紋:目前尚無65歲 (含)以上病人使用XEOMIN治療水平抬頭紋之臨床經驗。
上肢痙攣:在上肢痙攣的安慰劑對照研究中接受XEOMIN治療的283名病人,共有70位為65歲(含)以上、7位病人為75歲(含)以上。在老年病人和年輕病人之間沒有觀察到安全性或有效性的整體差異。在其他臨床研究中尚未發現老年病人和年輕病人之間的治療反應差異,但不能排除老年病人的敏感性增加。
頸部肌張力不全(痙攣性斜頸):在頸肌張力不全的第三期研究[參見臨床試驗資料(12)]中,共有29位病人年齡大於65歲,其中19位病人接受XEOMIN治療、10位病人接受安慰劑治療。在這之中,10位(53%)XEOMIN治療的病人和4位(40%)安慰劑治療的病人出現不良事件。 對於使用XEOMIN治療的65歲以上病人,最常見的不良事件是吞嚥困難(4位病人,21%)和虛弱(2位病人,11%)。 一位接受XEOMIN治療的病人(5%)出現嚴重的頭暈。
眼瞼痙攣:在眼瞼痙攣的第三期研究中[參見臨床試驗資料(12)],共有41位病人年齡大於65歲,其中在75位接受XEOMIN治療的病人中有29位(39%)、和34位接受安慰劑治療的病人中有12位(35%)。在這些病人中,29位接受XEOMIN治療的病人中有22位(76%)、12名接受安慰劑治療的病人中有7位(58%)出現不良事件。一位接受XEOMIN治療的病人出現嚴重的吞嚥困難。
【交互作用】
目前尚未針對XEOMIN進行過任何正式的藥物交互作用研究。
將XEOMIN和aminoglycoside類抗生素或其它會干擾神經肌肉傳導的藥物(如tubocurarine類肌肉鬆弛劑)併用時一定要小心,因為這些藥物可能會增強毒素的作用。
因此,XEOMIN 與 aminoglycosides 或 spectinomycin 併用時需要特別注意。使用周邊肌肉鬆弛劑時應審慎,必要時應減低鬆弛劑的起始劑量,或使用中效型藥物,例如 vecuronium 或atracurium,不應使用較長期持續作用的藥物。4‐Aminoquinolines 可能減少 XEOMIN 的療效。於投予XEOMIN之後使用抗膽鹼藥物可能會使全身性抗膽鹼作用增強。目前並不確知同時或在數月之內投予不同肉毒桿菌毒素產品對彼此的影響。在先前投予之肉毒
桿菌毒素的作用消退之前即投予另一種肉毒桿菌毒素,可能會使過度神經肌肉無力的現象更加惡化。在投予XEOMIN之前或之後投予肌肉鬆弛劑也可能會使過度無力的現象更加惡化。
【副作用/不良反應】
如同任何注射程序,注射可能會伴隨發生局部疼痛、發炎、感覺異常、感覺遲鈍、觸痛、腫脹/水腫、紅斑、搔癢、局部感染、血腫、出血、瘀青。
針刺相關疼痛、焦慮,可能會導致血管迷走神經反應,包括暫時性有症狀低血壓、噁心、耳鳴、昏厥。
當治療神經學適應症時,已有與毒素擴散至注射部位遠處相關的極罕見報告,產生與肉毒桿菌毒素作用一致的症狀(過度的肌肉無力、吞嚥困難和吸入性肺炎伴有致命的結果)。
下列和XEOMIN有關的不良反應在本仿單的其它段落中有較為詳盡的說明:
- 毒素作用擴散 [參見警語及注意事項(5.5)]
- 肉毒桿菌毒素產品之間不具可交換性 [參見警語及注意事項(5.5)]
- 過敏反應 [參見警語及注意事項(5.5)]
- 原先即患有神經肌肉疾病的病人 [參見警語及注意事項(5.5)]
- 抗體形成 [參見警語及注意事項(5.5)]
- 使用XEOMIN治療皺眉紋或眼瞼痙攣的病人發生眼瞼下垂風險 [參見警語及注意事項(5.5)]
- 使用XEOMIN治療痙攣性斜頸的病人發生吞嚥困難風險[參見警語及注意事項(5.5)]
過敏反應
曾有罕見報告嚴重和/或立即性過敏反應,包括全身性過敏反應、血清病、蕁麻疹、軟組織水腫和呼吸困難。
免疫刺激性
和所有的治療用蛋白質製劑一樣,本品也可能會產生免疫刺激性。抗體的發生率極為倚賴分析的敏感度與特異性。此外,在分析中所觀察到的抗體陽性發生率可能會受到多種因素的影響,包括分析的方法、樣本的處理方式、採集樣本的時機、併用的藥物、以及既有的疾病。基於這些原因,針對本類別之各種產品的抗體發生率進行比較可能會造成誤導。
【上市後經驗】
在XEOMIN的核准後使用期間,曾有發生下列不良反應的報告。由於這些反應都是由不特定大小的族群主動通報而得,因此並不一定能確切估算其發生頻率或確立其與使用藥物的因果關係:類流感症狀、過敏反應,如腫脹、水腫(亦有發生於遠離注射部位)、紅斑、搔癢、皮疹(局部及全身)及呼吸困難曾被報告過。
【過量】
XEOMIN過量可能會造成遠離注射部位的神經肌肉麻痺,伴隨各種不同的症狀(症狀可能包括全身無力、眼瞼下垂、複視、呼吸困難、言語困難、呼吸肌麻痹,或吞嚥困難導致發生吸入性肺炎)。因用藥過量而導致呼吸肌肉麻痺時,可能須施以呼吸支持治療。萬一用藥過量時,應監視病人是否出現過度肌肉無力或肌肉麻痺的症狀[參見警語及注意事項(5.5)]。可能須施以症狀治療。用藥過量的症狀可能不會在注射之後立即出現。如果發生意外注射或服用本藥的情形,用藥者應接受數週的醫療監督,觀察是否出現過度肌肉無力或麻痺的徵兆與症狀。萬一用藥過量時,對抗肉毒桿菌毒素的解毒劑並不能逆轉任何在投予解毒劑時已經出現的由肉毒桿菌毒素所造成的影響。
■藥物注意事項及包裝
包裝及儲存
第I型硼矽玻璃製單次使用型小瓶,附有不含乳膠成分的溴化丁基橡膠製瓶塞,以及安全鋁封,包裝規格如下:
包裝: XEOMIN 50單位; XEOMIN 100單位
效期
36個月
儲存條件
30°C以下
儲存注意事項
泡製後的XEOMIN應存放於2至8°C的冰箱中,並於24小時內給藥。XEOMIN在使用前應先以無菌、無防腐劑的0.9%氯化鈉注射液(USP)泡製。
如果泡製後的XEOMIN溶液呈混濁狀態,或含有塊狀物質或微粒異物,則不可使用。
任何已存放超過24小時的泡製後毒素注射液,以及任何未用完的注射液,都應丟棄不用。
■核准仿單電子檔下載(完整仿單資訊自附件下載參閱)
下載連結:點我下載完整仿單
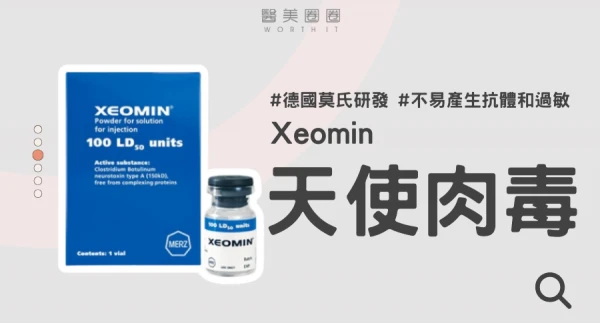
Q1:什麼是Xeomin 天使肉毒?
XEOMIN淨優明肉毒桿菌由德國莫氏MERZ研發,又稱天使肉毒。
經過高度純化不含複合性蛋白質,不易產生抗體和過敏反應,於2005年通過歐盟CE認證,2011年經美國FDA核準,台灣衛福部2016年2月認證。
Q2:肉毒桿菌是什麼?
由於臉部的肌肉收縮會牽動表面的皮膚而產生表情以及動態紋路,當皮膚逐漸老化、喪失彈性,隨著年齡漸長,臉上會逐漸產生皺紋,皮膚也變得鬆弛、下垂。
肉毒桿菌(Botulinum Toxin)是一種由肉毒桿菌(Clostridium Botulinum)分泌產生的神經毒素,能作用在神經末稍,以阻礙神經訊號傳遞,使肌肉放鬆、抑制肌肉收縮或腺體分泌。
當這些肌肉放鬆後,就不會一再活動它們而又形成表情紋,也能預防其他新紋路的產生。
經過一段時間,神經組織會再度恢復正常的傳導功能,這也就是為何肉毒桿菌素的作用有時限的原因。
Q3:Xeomin 天使肉毒的適應症?
1. 皺眉紋。
2. 魚尾紋。
3. 水平抬頭紋。
4. 眼瞼痙攣。
5. 頸部肌張力不全(痙攣性斜頸)。
6. 上肢痙攣。
Q4:Xeomin 天使肉毒的特色是什麼?
-XEOMIN天使肉毒是全球唯一純淨萃取、不含複合性蛋白的A型肉毒桿菌素產品,能減少免疫反應與抗體產生的風險,避免反覆施打而效果逐漸遞減或治療無效的情況發生。
-XEOMIN淨優明擁有美國FDA與台灣TFDA雙認證,可被人體100%吸收代謝,安全性高。
-XEOMIN淨優明可適應溫度為±40℃,大幅改善傳統肉毒桿菌需要低溫冷藏的變質風險。
Q5:Xeomin 天使肉毒的應用?
XEOMIN淨優明適合用於八字眉、魚尾紋、皺眉紋、法令紋、嘴角下垂等問題的改善。
Q6:我需要打多少天使肉毒?
肉毒桿菌的以單位U(Unit)來計算,市面上較常見的通常是以單位數(U)或是部位(區)來計價。
Xeomin 天使肉毒目前衛福部核可通過的50單位(U)或100單位(U)瓶裝的冷凍乾燥粉末。
皺眉紋:總建議劑量為每個療程20U,平均分成5個肌肉注射劑量,每劑4U。重複使用XEOMIN治療的頻率不可短於每3個月一次。
魚尾紋:每次治療的建議標準劑量為每側 12U,於單側眼周分為 3 個注射點注射,每一注射點注射 4 U。重複使用 XEOMIN 治療的頻率不可短於每 4 個月一次。
水平抬頭紋:依病人的個別需求而定,建議總劑量範圍為 10 至 20 U。配製 XEOMIN 之後,於額肌 5 個水平對齊的注射點,注射總劑量 10 至 20 U。每一注射點分別注射 2 U、3 U或 4 U。重複使用 XEOMIN 治療的頻率不可短於每 4 個月一次。
眼瞼痙攣:每個注射點的初始建議劑量為 1.25 至 2.5 U,每一眼的初始劑量不應超過 25 U。 每一療程總劑量不應超過 100 U。建議治療間隔為12週。
頸部肌張力不全(痙攣性斜頸):使用 XEOMIN 治療痙攣性斜頸,必須依個別病人的頭頸位置、可能疼痛位置、肌肉肥大、 病人體重、對注射的反應等,決定適當的用法用量。初始療程的建議總劑量為 120 U。治療間隔不建議短於 12 週。
上肢痙攣:治療上肢痙攣時,每一療程總劑量不應超過 400 U。治療間隔不建議短於 12 週。
*以上為原廠許可證建議之安全用量,建議至診所由專業醫師依照實際狀況評估治療。
Q7:Xeomin 天使肉毒注射會痛嗎?
一般會在注射部位先冰敷,和其他注射類型針劑比起來注射肉毒的針較細,僅會有輕微的扎針感,在眾多的注射類療程中算是疼痛感很輕微的。
Q8:Xeomin 天使肉毒注射多久後能看到效果?
XEOMIN首度開始發揮療效的中位時間為注射後 4 - 7天之內。個別病人的療效持續時間可能會明顯較長或較短。
Q9:Xeomin 天使肉毒有哪些副作用?
注射後較常見的副作用只是暫時性,包含局部瘀青、紅腫及頭痛,約在一週左右會消失。
如果在施打過後發生吞嚥、說話或呼吸障礙的現象,應立即就醫診治。
如果出現體力減弱、肌肉無力、眩暈、視覺模糊或眼瞼下垂的現象,應避免開車或從事其它可能有危險性的活動。
注射後可能會導致眨眼次數減少或眨眼效用減弱,因此,如果在治療後發生眼睛疼痛或眼睛刺激的現象,應立即就醫診治。
Q10:哪些人不能施打Xeomin 天使肉毒?
1.過敏:已知對活性成分肉毒桿菌神經毒素A型或任何賦形劑(人類白蛋白、蔗糖)過敏的病人,使用 本品可能會引發具生命威脅性的過敏反應。
2.原先即患有神經肌肉疾病的病人
3.注射部位感染或發炎
4.孕婦及授乳母親
5.兒童
下列狀況使用 XEOMIN 務必謹慎:
• 患有任何類型的出血疾病
• 病人正接受抗凝血藥物治療,或使用其他抗凝血藥物所含物質 • 患有肌萎縮性脊髓側索硬化症 (ALS) 的病人
• 患有其他疾病可能導致周邊神經肌肉功能障礙的病人
• 目標肌肉明顯無力或萎縮
不應注射超過 XEOMIN 的建議單次劑量。
對於原有動作不能或久坐不動的病人,為了神經性適應症而接受XEOMIN治療後,應建議病人在注射後逐漸恢復活動。
重複注射可能增加或減少 A 型肉毒桿菌神經毒素的臨床療效。
造成臨床療效變化的可能原因包括配製技術不同、選擇的注射間隔時間、注射的肌肉,以及採用的生物檢測程序導致毒素活性略有差異,或是繼發性無反應。
Q11:如何分辨Xeomin 天使肉毒的真偽?
Q12:Xeomin天使肉毒效果能維持多久?
Xeomin天使肉毒的效果維持時間因人而異,一般可以維持四至六個月。當效果逐漸消失以後,皺紋也會慢慢恢復。因此通常會建議每年定期治療二至三次,來維持沒有皺紋的狀態。
Q13:Xeomin天使肉毒術後需要注意什麼?
注射後注射部位可能會有暫時性的浮腫、局部瘀青為正常現象,可冰敷舒緩。
注射後2-3小時主動收縮和運動,治療部位避免按摩。
注射後4小時不可平躺、不能趴睡,以避免藥劑初期擴散。
注射後24小時避免日曬、飲酒、服用Aspirin或Vitamin E (會增加瘀青)
一週內請避免臉部去角質及使用果酸換膚等刺激性產品。
一週內請勿浸熱水浴、泡溫泉、洗三溫暖、日光浴、使用烤箱、蒸氣SPA或是到低溫極冷的地方。
民眾最想了解「Xeomin 天使肉毒」的問題是?
肉毒是什麼?天使肉毒是什麼?適應症?Xeomin 天使肉毒的特色?Xeomin 天使肉毒的應用?要打多少劑量?治療過程會痛嗎?多久看到效果?天使肉毒的副作用?天使肉毒的禁忌症?如何辨認原廠正貨?效果維持時間?天使肉毒dcard?
天使肉毒(淨優明Xeomin)是來自德國新一代純淨的肉毒桿菌素。是目前市場上「不含複合性蛋白」的肉毒產品,產生抗體的風險最低。適合需要長期施打肉毒桿菌素的求美者。效果自然,純淨零雜質,就像「天使」一樣。